definition af periodisk lov
 Det periodisk lov er han grundlaget for elementernes periodiske system, som universel ordning, der organiserer, klassificerer og distribuerer de forskellige eksisterende kemiske grundstoffer i forhold til deres egenskaber og egenskaber.
Det periodisk lov er han grundlaget for elementernes periodiske system, som universel ordning, der organiserer, klassificerer og distribuerer de forskellige eksisterende kemiske grundstoffer i forhold til deres egenskaber og egenskaber.
Basis, hvorpå elementernes periodiske system sidder
I mellemtiden bestemmer den periodiske lov, at de ovennævnte grundlæggende fysiske og kemiske egenskaber er tilbøjelige til systematisk gentagelse, når elementernes atomnummer stiger.
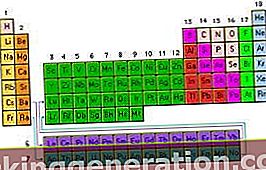
Periodisk tabel: organisering af de kemiske grundstoffer i stigende rækkefølge til antallet af atomer, som hver enkelt har
Den så berømte tabel over de grundstoffer, som vi studerer i skolen, inden for emnerne fysik og kemi, er en ordning, der beskæftiger sig med at ordne de kemiske elementer i henhold til deres stigende rækkefølge med hensyn til antallet af atomer.
De lodrette kolonner i tabellen kaldes grupper og indeholder elementerne med den samme atomvalens og har derfor lignende egenskaber, mens de vandrette rækker, kaldet perioder, grupperer elementerne med forskellige egenskaber, men har lignende masser.
Hvordan denne viden blev avanceret: specifikke og gradvise begivenheder
Det skal bemærkes, at alle disse begreber, der er forbundet med fysik og kemi, blev udviklet gradvist og progressivt i løbet af det nittende århundrede.
Vi må sige, at nogle elementer såsom sølv (Ag), guld (Au), kobber (Cu), bly (Pb) og kviksølv (Hg) allerede havde en perfekt viden siden oldtiden, den første videnskabelige opdagelse af et element skete i løbet af det syttende århundrede, da alkymisten Henning Brand først identificerede elementet fosfor (P).
I det følgende århundrede, det vil sige i det 18. århundrede, begyndte nye grundstoffer at blive kendt, de mest relevante var gasser takket være udviklingen af pneumatisk kemi, herunder ilt (O), nitrogen (N) og hydrogen (H).
Omkring dette tidspunkt skrev den franske kemiker Antoine Lavoisier en liste over enkle stoffer, hvor der allerede var 33 elementer.
I begyndelsen af det nittende århundrede udløste opfindelsen af det elektriske batteri studiet af nye kemiske fænomener, og dette endte med at generere opdagelsen af flere grundstoffer, såsom alkali og jordalkalimetaller.
I 1830 var 55 elementer allerede blevet identificeret.
I midten af det nittende århundrede, med opfindelsen af en enhed kaldet et spektroskop, blev der fundet flere elementer, især dem der var forbundet med farve, der præsenterede deres spektrale linjer, herunder cæsium, thallium og rubidium, for at nævne nogle få.
Spektroskopet er et instrument, der bruges til at observere og opnå et spektrum, idet det er resultatet af en spredning af en række strålings-, lyd- eller bølgefænomener.
Ligheden, som visse elementer præsenterede med hensyn til kemiske og fysiske egenskaber, fik nogle datidens forskere til at beslutte at ordne dem systematisk og gruppere dem efter bestemte kriterier.
Det mest afsidesliggende fortilfælde, vi har af den pågældende lov, er det velkendte Law of Octaves, udviklet af den engelske kemiker John Alexander Newlands, som foreslog at vække en stor nyhed, at hvert otte element vi befinder os over for lignende egenskaber.
Dette var kickstarten for ham til at formulere sit eget periodiske system, der blev offentliggjort i 1863.
Som om man var i et løb, blev handsken i denne forstand afhentet af en anden kemiker, i dette tilfælde Tyske Julius Lothar Meyer, der som udgangspunkt anvendte resultaterne fra Newlands i 1870, bestemte elementernes atomvolumen.
Når han først havde beregnet atomvægtene og repræsenteret dem, var han i stand til at demonstrere for videnskabens verden, at atomvægten indebærer en stigning i fysiske egenskaber.
Og næsten samtidig med Meyers værker, Russisk-fødte kemiker Dimitri Mendeleev offentliggør første periodiske system, at slå Meyer, der ville gøre det et år senere, og derfor er han den, der er forblevet med fortjenesten at være dens skaber.
Mendeleev ville ordne elementerne i stigende rækkefølge baseret på den atommasse, de præsentererI mellemtiden placerede han dem, der delte nogle egenskaber i samme kolonne.
Det er værd at nævne, at på dette tidspunkt var 63 elementer af de 90 eksisterende allerede kendt.
Bordet blev afsluttet i slutningen af det 19. århundrede med en anden gruppe, kaldet nul, og sammensat af ædelgasser.










